5 marzo 2011 ore 17.30
Da Democrito a De Broglie: la forza del pensiero
nella storia dell’atomo.

Quando si presenta ai non addetti ai lavori il concetto di atomo e, di conseguenza, di molecola è normale sentirsi chiedere come si possa parlare di ciò che non si vede. E’ quanto è capitato nell’Associazione in uno degli incontri culturali dello scorso anno in cui si parlava di architetture molecolari.
La quotidiana esperienza con il meccanismo del vedere ci da la certezza della realtà. Ciò che è fuori di noi viene acquisito come immagine, che è una copia della realtà. Forse è meglio dire che due realtà (il mondo fuori di noi e noi) vengono in contatto attraverso la radiazione elettromagnetica, o attraverso gli ultrasuoni nel caso dei chirotteri o attraverso il tatto o il fiuto. Cioè la radiazione riflessa dall’oggetto entra nell’occhio che con un sistema di lenti naturali fa convergere la radiazione sulla retina, che converte il segnale in segnale elettrico. Successivamente il nervo ottico veicola questo segnale al cervello dove viene analizzato e convertito in quella che noi chiamiamo immagine. Analogo meccanismo è invocabile con gli altri sistemi di contatto.
Se invece noi abbiamo di fronte una realtà che non riusciamo a vedere con tale meccanismo, e la “colpiamo” con un’indagine opportuna (può essere una semplice pesata, oppure un reazione con un agente chimico, oppure un’ immersione in un campo elettrico o elettromagnetico o acustico) e osserviamo poi il modo in cui la “realtà” reagisce allo stimolo, sottoponendo ad analisi logica la risposta della realtà, possiamo avere una visione della realtà!
Quando si parla di natura atomica della materia bisogna necessariamente partire dalla Grecia classica, che affrontò la problematica del CONTINUO e del DISCONTINUO.
Nel pensiero Greco lo spazio geometrico era continuo per cui, dato uno spazio (linea, superficie volume), si poteva passare da un punto all’altro di questo spazio senza soluzione di continuità, si rimaneva cioè sempre entro quello spazio. Per il mondo fisico invece esistevano due pensieri: nella scuola socratica si riteneva che anche lo spazio fisico fosse continuo, mentre nella scuola di Leucippo e di Democrito, suo discepolo, lo spazio fisico era discontinuo, composto cioè di “pezzettini” di materia, che chiamarono ATOMI, cioè indivisibili. Gli atomi erano dispersi nel vuoto. Quindi essere e non essere (atomi e vuoti) erano dei principi (archè). Questi atomi erano dotati di continuo movimento. Questa visione è molto moderna e anticipatrice!
Gli atomi si differenziavano per forma, posizione e ordine. Il loro moto continuo poteva rendere conto delle trasformazioni. Essi non interagivano a distanza ma solo per contatto.
Questa visione fu molto avversata dai socratici e soprattutto da Platone; a Roma trovò seguito tra gli epicurei, ad esempio Tito Lucrezio Caro.
Successivamente, durante tutto il Medioevo ed oltre fino al Rinascimento fu fortemente avversata dalla Chiesa, soprattutto per il motivo che anche il non essere (i vuoti) era un principio. In questo lungo periodo trovò quindi accoglimento la visione socratica continua della materia, in cui la trasformazione materiale era considerata come una compenetrazione delle proprietà dei corpi.
Queste due visioni non poggiavano su una prova fisica, erano solo speculazioni e questa incertezza durò a lungo fino a Dalton e Proust (XIX secolo).
E’ giusto comunque ricordare che Pierre Gassendi (1592-1655), canonico a Digne, ebbe il coraggio di riprendere la teoria atomica, tentando una conciliazione con la Chiesa. Egli cercò di mediare introducendo il concetto di VACUUM SEPARATUM, cioè un vuoto infinito in cui Dio aveva creato il mondo finito. In questo mondo egli assume l’esistenza di un VACUUM DISSEMINATUM, un aggregato di piccoli vuoti distribuiti tra gli atomi.
Nel XVII secolo, Boyle (noto per la sua legge dei gas) era un sostenitore della teoria atomica e nel XVIII secolo Lavoisier definì la conservazione della massa e trovò un certo numero di sostanze elementari (cioè non scomponibili in altre sostanze più semplici): gli Elementi. Inoltre confutò la teoria del flogisto e dei quattro elementi (aria, acqua, terra e fuoco). Si stavano formanodo quindi le basi culturali per un passo in avanti decisivo.
Era importante aver superato l’avversione fondamentalista della Chiesa e quindi poter parlare di questo sconosciuto: l’Atomo.
Comunque doveva passare ancora del tempo prima che si avesse una prova certa della discontinuità della materia.
Fu la bilancia a dirimere i dubbi. Proust Joseph Louis (1754-1826) trovò che il rapporto in peso tra due elementi che reagiscono è costante ed espresso da numeri piccoli ed interi. Ad esempio 40 grammi di Calcio reagiscono con 32 grammi di zolfo, cioè secondo un rapporto 5/4.
Inoltre nei primi anni del 1800 Dalton formulò la legge delle propozioni multiple. Secondo questa legge (le cui basi sperimentali sono, come lo era stato per le esperienze di Proust, misure di pesi) i diversi pesi della sostanza B che reagiscono con la stessa quantità della sostanza A stanno fra loro come numeri piccoli ed interi.
Cioè trovando sperimentalmente che 55 grammi di ferro reagiscono con 16 grammi di ossigeno o in altre condizioni con 24 grammi di ossigeno, se reagire significasse compenetrazione della materia ci si aspetterebbe che tutti i valori di peso di ossigeno tra 16 e 24 grammi potrebbero reagire con i 55 grammi di ferro. Se invece ammettiamo che la materia sia discontinua sono gli atomi e le loro possibilità di agganciare altri atomi a definire i rapporti di peso di cui si parlava sopra.
Ecco l’ esempio di come un’ esperienza (la misura di pesi) in questa “visione” rappresenti il fascio di luce che colpisce l’oggetto e il pensiero sostituisca l’analisi cerebrale del messaggio della retina. Queste leggi provano il modello discontinuo della materia e sono quindi uno spartiacque fra il vecchio atomismo e l’atomismo moderno.
Da questo momento in poi l’affinamento del modello compie passi da gigante. Infatti la scoperta dell’elettricità, la “macchina di Volta”, indirizzarono il pensiero dei chimici verso una visione elettrica dell’atomo. Inoltre le ricerche di Gay-Lussac per cui i gas si combinano tra loro in proprozioni volumetriche espresse da numeri piccoli ed interi insieme al principio di Avogadro (volumi eguali di aereiformi diversi, alle stesse condizioni di pressione e temperatura, contengono lo stesso numero di molecole, che potevano essere composte da più atomi) dettero ulteriore conferma della legge di Dalton.
Nel 1897 Thomson scopre l’elettrone, a cui con le esperienze di Millikan viene attribuita una massa 1836 volte più piccola di quella dell’idrogeno. Viene quindi determinato sperimentalmente che esso è un costituente di tutti gli atomi.
Si ipotizzò di conseguenza un modello di atomo da parte di Thomson e di Lord Kelvin: una matrice sferica di carica positiva in cui erano dispersi gli elettroni.
Ora non bastava più qualche pesata per “vedere” la struttura dell’atomo. Occorreva un metodo di indagine più penetrante.
Ma la scoperta della radioattività da parte di Becquerel Antoine Henri (1852-1908) di M.me Curie e Pierre Curie fornirono “l’occhio indagatore adeguato”. Infatti i raggi alfa (particelle positive di massa quattro volte quella dell’idrogeno) prodotte dal decadimento di materiali radioattivi, furono usate per bombardare i materiali. Stranamente una certa percentuale di queste particelle venivano deflesse mentre altre passavano indisturbate. Ciò dimostrava che l’atomo non era uniforme: vi era una zona in cui praticamente era concentrata la quasi totalità della massa, che rifletteva le particelle alfa che passavano vicino, e poi c’era uno spazio praticamente vuoto dove ruotavano i piccolissimi elettroni, incapaci di opporsi al moto delle particelle alfa. Si aveva cioè una massa centrale e uno spazio vuoto intorno in cui si trovavano gli elettroni. Questo è il modello planetario di Rutherford (1911).
Anche se questo modello interpretava il fenomeno della deflessione delle particelle alfa da parte degli atomi non rendeva conto del perché gli atomi fossero stabili nonostante le leggi dell’elettrodinamica secondo le quali una carica elettrica in moto accelerato emette energia sotto forma di radiazione elettromagnetica, rendendo quindi instabile l’atomo.
Nel frattempo era nata quella scienza che permetterà di indagare ancora più profondamente la materia: la spettroscopia, cioè lo studio dell’interazione tra materia ed energia elettromagnetica.
E’ questo un periodo di grande travaglio concettuale per trovare un modello attendibile. Se l’energia elettromagnetica (di cui la luce è una parte) nell’800 era considerata CONTINUA, nel ‘900 viene ad essere considerata discontinua (Planck, radiazione emessa dal corpo nero, e Einstein, effetto fotoelettrico) costituita cioè da “particelle” di energia, chiamati fotoni. E quale modello viene allora adottato per l’atomo? Bohr rompe con la meccanica classica e sarà seguito da Sommerfeld, Schrödinger propone le equazioni delle onde stazionarie come mezzo per conoscere la natura intima dell’atomo. Andiamo per ordine, avendo in mente i seguenti fatti:
1) la radiazione elettromagnetica è una perturbazione periodica di campi elettrici e magnetici.
2) La periodicità della perturbazione è caratterizzata da una frequenza, cioè un numero che dirà quante volte nell’unità di tempo il campo elettrico o magnetico compie una oscillazione completa.
I fisici e i chimici ora volgono l’attenzione allo SPETTRO di una sostanza, cioè ad una “collezione” di frequenze elettromagnetiche che vengono emesse da una sostanza eccitata: infatti in tale processo viene emessa radiazione composta da particolari frequenze.
L’atomo, in condizioni normali, è stabile e non emette radiazione. Solo se in qualche modo viene eccitato, rilascia poi l’energia acquisita e ogni atomo ha sempre un ben definito e caratteristico spettro di emissione dell’energia elettromagnetica.
Bohr suppose (in disaccordo con la fisica conosciuta ai suoi tempi) che ogni atomo ha stati energetici ben definiti e che l’elettrone può risiedere in uno di questi stati senza perdere energia (stati stazionari). Solo se cambia stato può emettere o assorbire energia. Impone che questi stati siano identificati da un’equazione che stabilisce che il momento della quantità di moto dell’elettrone nell’orbita circolare sia un multiplo intero della quantità fondamentale h/2p, dove h è la costante di Planck. Perché fa questa imposizione? Perché da questo assunto riusciva per calcolo ad ottenere lo spettro dell’atomo di idrogeno.
Nel 1932 Chadwick scopre il neutrone che con il protone (l’elemento positivo dell’atomo) viene a costituire il nucleo.
Sommerfeld estende l’ipotesi di Bohr anche ad orbite ellittiche ed in questo modo riesce ad ottenere per calcolo che alcune frequenze sono in realtà costituite da due frequenze molto vicine.
Occorreva però una teoria che non si basasse su assunti ad hoc, imposti per ottenere delle spiegazioni di un particolare esperimento.
Nel frattempo nascevano numerose evidenze sperimentali che mostravano che le particelle atomiche o subatomiche avevano comportamenti ondulatori.
Cioè se nella fisica classica il moto ondulatorio produceva i fenomeni della rifrazione e della diffrazione, fenomeni che non erano esibiti dai corpi materiali macroscopici, nella fisica atomica anche i corpuscoli materiali davano questa fenomenologia.
Fu Louis De Broglie che con la sua ipotesi unficò i due comportamenti: ipotizzò che le particelle elementari si comportano come onde di lunghezza d’onda ħ/p, dove p è la quantità di moto. Questa sua ipotesi, di rottura con il passato, ora conosciuta con il termine dualismo onda particella, unifica i due comprtamenti corpuscolare e ondulatorio. Fotoni e corpuscoli hanno lo stesso comportamento. All’ONDA viene attribuito il significato di onda di probabilità. Cioè il quadrato dell’ampiezza dell’onda d’ora in poi è legato alla probabilità di trovare il corpuscolo (energetico o materiale). Nasce contemporaneamente la concezione dell’indeterminazione (Heisenberg): qualsiasi misura altera inevitabilemnte lo stato dei sistemi “piccoli” e quindi non si può conoscerne con esattezza posizione e quatità di moto. Il determinismo della fisica classica cede il posto al probabilismo.
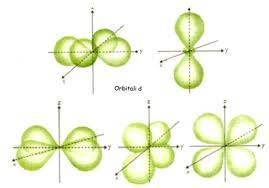
Questa teoria permette quindi di costruire delle superfici (orbitali) che inviluppano regioni dello spazio dove è altamente probabile di trovare l’elettrone di un atomo. Non abbiamo più la certezza di trovarlo in un determinato punto o in una determinata traiettoria. Ma anche questa visione torna utile: infatti dato che nelle reazioni chimiche quello che varia è l’assetto elettronico esterno di un atomo si possono costruire modellini molecolari a partire dagli orbitali. Quando un atomo A reagisce con un atomo B il legame tra loro sarà assicurato dall’interazione reciproca degli elettroni esterni. E’ possibile quindi, conoscendo la geometria degli orbitali elettronici, capire come i due atomi A e B debbano sistemarsi perché i loro orbitali interagiscano al massimo (sovrapposizione degli orbitali). E si possono quindi prevedere le strutture molecolari.
G.Berchiesi